GLOSSARIO: Biosimilari
Offrono alternative efficaci e potenzialmente più economiche ai biologici originatori, con importanti implicazioni per l'accesso alle cure e la sostenibilità dei sistemi sanitari. [Lettura 7 min]
Le biotecnologie hanno rivoluzionato il panorama terapeutico, consentendo lo sviluppo di terapie innovative per una vasta gamma di patologie di rilevanza clinica ed epidemiologica.
Lo sviluppo e la produzione di questi farmaci comportano investimenti considerevoli, e sollevano questioni importanti sulla sostenibilità economica e sull'allocazione ottimale delle risorse sanitarie.
L'avvento dei farmaci biosimilari rappresenta una svolta significativa: con la scadenza dei brevetti dei farmaci biologici originatori, i biosimilari sono alternative terapeutiche "simili" in termini di qualità, efficacia e sicurezza, ma a costo inferiore.
Medicinali biologici
Secondo la definizione dell'EMA, sono farmaci contenenti principi attivi derivati da fonti biologiche o processi biologici.
Le loro caratteristiche principali sono:
Composizione: sono molecole più grandi e complesse rispetto ai farmaci tradizionali, principalmente proteine di varia complessità, da semplici come l'insulina a complesse come gli anticorpi monoclonali.
Processo produttivo: utilizzano processi biotecnologici avanzati, spesso con sistemi cellulari sofisticati e tecnologia del DNA ricombinante.
Eterogeneità: è dovuta a fattori come la cellula ospite, i plasmidi utilizzati e le condizioni di crescita.
Variabilità intrinseca: essendo prodotti da organismi viventi, mostrano un certo grado di variabilità anche tra gli stessi lotti. La variabilità deve rientrare in un range accettabile.
Immunogenicità: possono indurre risposte immunitarie, generalmente limitate, ma in rari casi potenzialmente gravi, che possono influenzare l'efficacia e la sicurezza del farmaco.
Regolamentazione: oltre ai controlli standard, sono richieste anche informazioni dettagliate sul processo produttivo e sul potenziale immunogenico. La produzione deve rispettare le Good Manufacturing Practice (GMP) dell'UE.
Tra i medicinali biologici si annoverano farmaci biotecnologici diversi, per esempio:
Anticorpi monoclonali: adalimumab (artrite reumatoide, psoriasi, malattie infiammatorie intestinali); infliximab (artrite reumatoide, malattia di Crohn, colite ulcerosa); rituximab (artrite reumatoide e alcuni tipi di linfoma); trastuzumab (cancro mammario HER2-positivo).
Proteine di fusione: etanercept (artrite reumatoide, artrite psoriasica, spondilite anchilosante).
Ormoni ricombinanti: insulina, eritropoietina
Fattori di crescita: Filgrastim
Interferoni
Vaccini: contro papillomavirus umano (HPV), epatite B
Enzimi ricombinanti: alglucosidasi alfa (malattia di Pompe)
La loro complessità richiede una rigorosa standardizzazione delle fasi di produzione e controlli integrati per garantirne qualità, sicurezza ed efficacia.
Biosimilari
Sono medicinali biologici molto simili a un prodotto biologico di riferimento già autorizzato (originatore), per il quale sia scaduta la copertura brevettuale.
Definizione e caratteristiche: i biosimilari sono sviluppati per essere analoghi a un biologico già approvato di riferimento: contengono lo stesso principio attivo dell’originatore, ma possono presentare minime differenze dovute alla complessità dei processi produttivi. Devono avere la stessa posologia e via di somministrazione dell’originatore.
Quadro normativo: è definito dalla Direttiva 2001/83/EC: l'EMA ha fornito una definizione specifica nel 2012, sottolineando la similarità ma non l'identità con il prodotto di riferimento.
Processo di approvazione: sono autorizzati con una procedura centralizzata dell'EMA. Il richiedente deve fornire risultati di prove precliniche e cliniche appropriate, dimostrando che le eventuali differenze non influiscono su sicurezza ed efficacia.
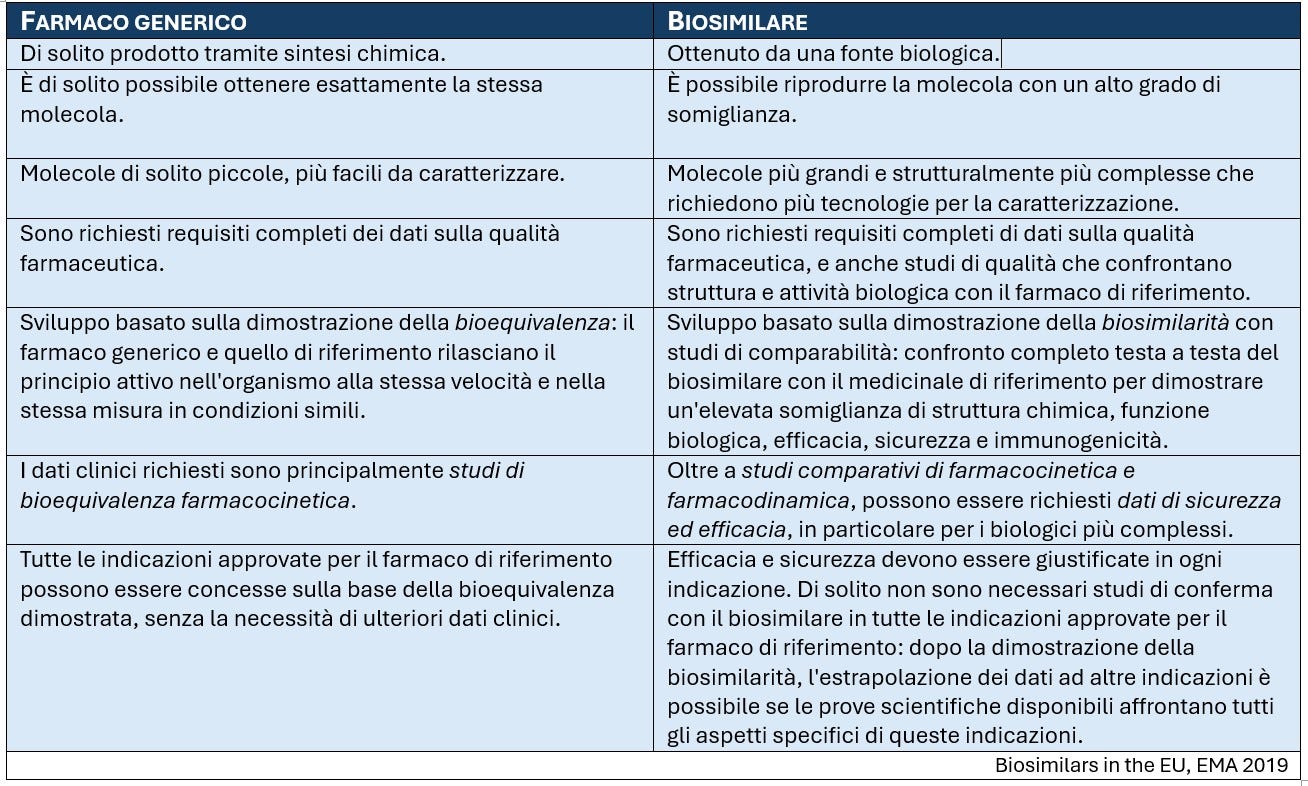
Differenze rispetto ai farmaci generici: un biosimilare non è considerato un generico di un farmaco biologico, principalmente perché la variabilità naturale e la complessità produttiva dei biologici non consentono una replica esatta della microeterogeneità molecolare. Per l'approvazione normativa dei biosimilari sono necessari più studi rispetto ai generici, per garantire che le differenze minori non influiscano sulla sicurezza o sull'efficacia.
Tipologie approvate: la maggior parte dei biosimilari approvati nell'UE contiene proteine come principio attivo.
Vantaggi: possono essere commercializzati dopo la scadenza del brevetto del medicinale di riferimento (10 anni) e offrono un'opzione terapeutica potenzialmente più economica, aumentando l'accesso ai trattamenti biologici.
Sicurezza
Dall'introduzione del primo biosimilare nel 2006, l'Unione Europea ha sviluppato un sistema di farmacovigilanza per garantire la sicurezza di questi farmaci.
Il monitoraggio della sicurezza dei biosimilari segue gli stessi rigorosi standard applicati a tutti i farmaci biologici, senza requisiti specifici aggiuntivi.
Come tutti i farmaci sottoposti a monitoraggio addizionale, anche i biologici hanno un triangolo nero rovesciato sul foglietto illustrativo, sulla scheda tecnica e sui prontuari.
Le reazioni avverse ai biosimilari sono generalmente prevedibili in base all'azione farmacologica e simili a quelle del medicinale di riferimento: nell'UE sono stati approvati più di 50 biosimilari ma fino a oggi nessuno è stato ritirato o sospeso per motivi di sicurezza o efficacia.
Un aspetto cruciale per la sicurezza dei farmaci biologici, inclusi i biosimilari, è la tracciabilità.
È fondamentale identificare questi farmaci attraverso il nome commerciale e il numero di lotto, specialmente quando esistono più farmaci con lo stesso principio attivo: ciò va tenuto presente, sia registrando queste informazioni nelle cartelle cliniche dei pazienti, sia indicandole nelle segnalazioni di eventuali reazioni avverse.
Per migliorare il processo di farmacovigilanza, l’EMA consiglia agli operatori sanitari di:
Registrare nome commerciale e numero di lotto a tutti i livelli, compresa la dispensazione e la somministrazione al paziente.
Includere il nome commerciale del farmaco nella prescrizione.
Assicurarsi che nome commerciale e numero di lotto siano indicati in caso di sospette reazioni avverse.
Fornire al paziente nome commerciale e numero di lotto quando il prodotto viene dispensato in una farmacia comunitaria.
Registrare nome commerciale e numero di lotto di ciascun medicinale quando un paziente passa da un medicinale biologico a un altro con lo stesso principio attivo.
Intercambiabilità
Secondo la definizione dell'OMS è intercambiabile “un prodotto che si prevede abbia lo stesso effetto clinico di un prodotto comparatore e possa essere sostituito ad esso nella pratica clinica”.
Si può trattare della sostituzione di un prodotto di riferimento con un biosimilare (o viceversa) o della sostituzione di un biosimilare con un altro.
La sostituzione di un farmaco, in generale, può avvenire tramite:
Switching, ovvero quando il prescrittore decide di passare da un farmaco a un altro farmaco con lo stesso intento terapeutico.
Sostituibilità automatica: è la pratica di dispensare un farmaco al posto di un altro farmaco equivalente e intercambiabile a livello di farmacia, senza consultare il prescrittore.
L’EMA ha lasciato ai singoli stati membri la decisione se consentire l'uso intercambiabile e la sostituibilità automatica del farmaco biologico di riferimento con il biosimilare.
In Italia la posizione dell’AIFA chiarisce che i medicinali biologici e biosimilari non possono essere considerati sic et simpliciter alla stregua dei prodotti generici, o equivalenti.
Pertanto, né il farmacista né il paziente possono modificare la prescrizione del medico.
Biosimilars in the EU
EMA, 2019
Secondo Position Paper AIFA sui Farmaci Biosimilari
AIFA
Decalogo sui farmaci biosimilari - Informazioni per i pazienti
AIFA